"화학반응식과 양적 관계" 기출문제 2편입니다.
[1편 바로가기]
[고등화학1] 화학반응식과 양적 관계 기출문제 1편 : 여러분의 풀이와 비교해보세요
"화학반응식과 양적 관계" 기출문제 1편입니다.. 막막하기 쉬운 단원입니다. 저 역시도 예전 고2 / 고3 시절을 떠올려보면 화학이 항상 막막했었습니다. 그러나 그러한 막막함이 개운함으로 바뀌
juningscience.tistory.com
.
.
막막하기 쉬운 단원입니다.
저 역시도 예전 고2 / 고3 시절을 떠올려보면 화학이 항상 막막했었습니다.
그러나 그러한 막막함이 개운함으로 바뀌는 순간은
문제를 바라볼 때, "어떻게 시작해야 할까?"에 대한 고민을 하기 시작하면서부터 였습니다.
여러분도 그 질문을 스스로에게 던져보세요.
그리고 고민해보세요.
.
아래에는 제가 생각하는 효율적인 풀이를 적어보았습니다.
여러분의 풀이와 비교해보세요!
그럼 시작해봅시다.

.
.

[해설] 실험 II의 자료에 집중해봅시다.
왜냐하면 실험 II에서 준 자료가 더 많기 때문입니다.
화학에서는 항상 유념해야 하는 사실이 있습니다.
"펜이 멈춘다면, 비율값을 실제값처럼 놓고 들어갈 줄 알아야 한다."
.
실험 II에서 'C의 양(mol) / 전체 기체의 양(mol) = 8/9' 입니다.
저는 그냥 C의 양이 8mol 생성되었고
반응 후 전체 기체의 양이 9mol 이라고 놓아보겠습니다.
실험 II에서 B가 모두 반응하였으므로 반응 후 A가 1mol 남으면 됩니다.
여기서 이런 생각을 해야 합니다.
우리는 지금 반응 후 A, C 몰수를 알고 있습니다.
또한 문제에서 A, C의 분자량 비를 알려주었습니다.
따라서 반응 후 존재하는 A, C의 질량 비를 구할 수 있는 것입니다.
몰수비는 A : C = 1 : 8 이고
분자량비는 A : C = 4 : 5 이므로
반응 후 질량비는 A : C = 1 : 10 입니다.
.

반응 후 질량비가 A : C = 1 : 10 이려면
A가 얼마나 반응해야 할까요?
8w 반응하면 됩니다.
그러면 생성되는 C의 질량이 10w 이기 때문입니다.
반응 질량비는 A : B : C = 8 : 2 : 10 = 4 : 1 : 5 입니다.
.
A wg 이 1mol 에 해당하므로 8wg은 8mol에 해당합니다.
이때 C가 8mol 생성되었으므로 A와 C의 계수는 같아야 합니다.
c = 2 입니다.
따라서 반응 몰수비는 2 : 1 : 2 이고
이제 분자량 비를 구할 수 있습니다.
분자량 비는 A : B : C = 4 : 2 : 5 입니다.
.
위 문제의 답은 2번 입니다.
.
.
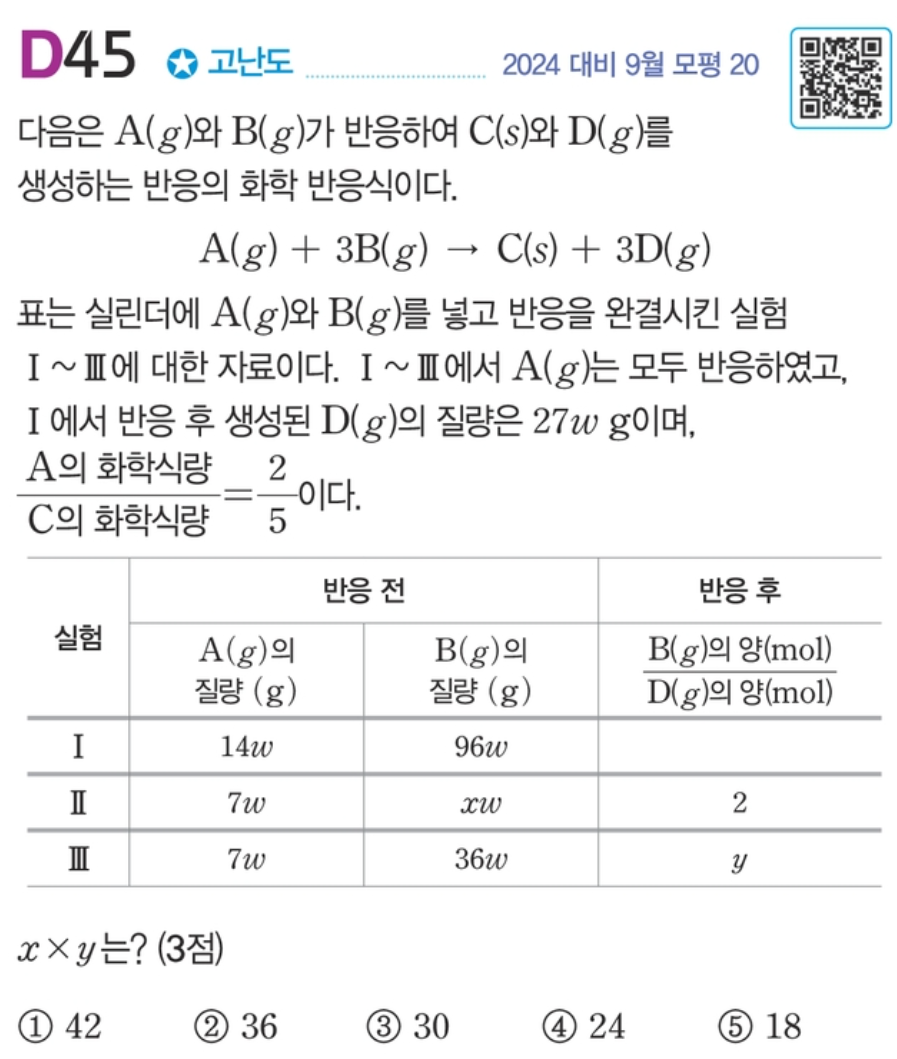
[해설] 화학반응식과 양적관계 단원에서 유념해야 하는 사실이 있습니다.
"화학식량 비를 주는 이유는 결국 질량 비를 주기 위함이다."
.
A와 C의 반응 몰수 비는 1 : 1 입니다.
A와 C의 화학식량 비는 2 : 5 로 주어졌습니다.
그러므로 A와 C의 반응 질량 비는 2 : 5 가 됩니다.
.
실험 I에 집중해봅시다.
A는 14wg 반응하였으므로 C는 35wg 생성됩니다.
또한 문제에서 D는 27wg 생성된다고 알려주었습니다.
그러므로 질량 보존의 법칙에 의해 B는 48wg 반응하여야 합니다.
반응 질량 비는 A : B : C : D = 14 : 48 : 35 : 27 입니다.
반응 몰수 비는 A : B : C : D = 1 : 3 : 1 : 3 이므로
분자량 비는 A : B : C : D = 14 : 16 : 35 : 9 입니다.
앞으로 위 분자량 비를 실제 분자량으로 생각해봅시다.
.
이제 실험 II에 집중해봅시다.
A는 7wg 반응하였으므로 D는 27wg/2 생성됩니다.
즉 생성된 D의 몰수는 1.5 mol 이라고 생각할 수 있습니다.
문제 자료에서 B의 몰수 / D의 몰수 = 2 이므로 남아있는 B의 몰수는 3mol 입니다.
반응한 B의 몰수가 1.5mol 이므로 초기 B의 질량은 4.5 X 16 = 72 입니다. ( x = 72 )
.
위 문제의 답은 36 입니다.
.
.
3편으로 찾아오겠습니다.
수고하셨습니다!

'화학1 해설 저장소 > 기출문제 해설' 카테고리의 다른 글
| 화학1 - 몰농도 기출문제 1편 : 최신 트렌드는 비율 해석 (0) | 2025.01.23 |
|---|---|
| 화학1 - 화학반응식과 양적 관계 기출문제 1편 : 문제 풀이 꿀팁 (0) | 2024.12.25 |
| 화학1 - 화학식량과 몰 기출문제 4편 : 문자 최소화 풀이법 (0) | 2024.12.15 |
| 화학1 - 화학식량과 몰 기출문제 3편 : 비율값은 실제값으로 생각하기 (0) | 2024.12.15 |
| 화학1 - 화학식량과 몰 기출문제 2편 : 핵심 포인트는? (1) | 2024.12.15 |



