수용액 (가)의 pH가 수용액 (나)의 pH보다 3크다면, pOH는 어떤 상관관계가 있을까요?
수용액 (나)의 pOH가 3 더 클 것입니다.
왜냐하면, pH+pOH = 14 (단, 25도) 로 일정하기 때문이죠.
이를 이용한 문제 두가지를 내어보겠습니다.
.
Q1) 수용액 (가), (나)의 H+ 몰수비는 10^4 : 1 이다.
수용액 (가), (나)의 OH- 몰수비는 1 : 10^6 이다.
수용액 (가), (나)의 부피비는 ?
.
A) [H+] 의 (가), (나) 비율과 [OH-]의 (가),(나) 비율은 순서만 다를 것입니다.
그렇게 되도록 문제에 나온 몰수비를 만져주면, (가) 쪽 H+, OH-에 10을 곱해주면 됩니다.
그러면, [H+]는 10^5 : 1
[OH-]는 10 : 10^6 = 1 : 10^5 가 됩니다.
(가) 쪽에 10을 곱해줘서 딱 몰농도 비율이 맞춰졌으니,
(가)의 부피가 (나)의 부피보다 10배 더 작았을 것입니다.
2)
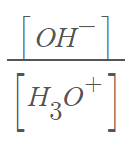
Q2) 위 비율이 수용액 (가), (나)에서 1: 10^6 이라고 합시다.
수용액 (가), (나)의 pOH 차이는?
수용액 (가), (나)의 pH 차이는?
A) 분자가 1:10^3 이면, 분모도 자동으로 10^3 : 1 일 것입니다.
그래서 pH, pOH 모두 3차이가 납니다.
728x90
반응형
'화학1 해설 저장소 > 기타 자료 해설' 카테고리의 다른 글
| [고등화학1] "양이온수 / 음이온수 (중화반응)" 자료를 대하는 법 : 2편 (0) | 2024.08.16 |
|---|---|
| [고등화학1] 1단원 화학반응식 양적관계 : 질량 자료가 나올 때 문제풀이 3편 (0) | 2024.08.16 |
| 화학1 - 화학반응식 양적관계 문제 2편 : 질량 자료 해석법 (0) | 2024.08.16 |
| 화학1 - 화학반응식 양적관계 문제 1편 : 질량 자료 해석법 (0) | 2024.08.16 |
| [고등화학1] "양이온수 / 음이온수 (중화반응)" 자료를 대하는 법 : 1편 (0) | 2024.08.16 |

