2024년 10월 15일에 치뤄진 고3 화학1 10월 전국연합학력평가입니다.
..등급컷이 아주 무섭네요..

작년부터 50점이 1등급입니다.
현 고2 학생들은 이러한 상황을 고려해보아야 하겠습니다.
물론 쫄건 없지만요..!!
.

EBS에서 집계된 오답률 탑5 문항입니다.
12번은 중화적정 문제 / 13번은 화학식량과 몰 문제 / 16번은 산화환원 반응식 완성 문제였습니다.
19, 20번 문항은 여러분의 예상대로 중화반응과 화학반응식 문제입니다.
.
.
생각해볼 가치가 있는 문제들을 선별해보았으니, 같이 살펴봅시다.
문제 아래에는 제가 생각하는 효율적인 시작을 적어보았습니다.

.
.

[시작] (나) 과정에서 용액의 부피가 20mL에서 100mL로 5배가 되었습니다.
용질의 몰수는 변하지 않았으므로 용액의 몰농도는 1/5배가 되었을 겁니다.
그러므로 a는 0.06 X 5 = 0.3 이 됩니다.
.
(나)에서 만든 A 50mL 에는 3mmol 이 들어있습니다.
(다)에서 최종적으로 녹아있는 A의 몰수는 8mmol 이므로 5mmol을 추가해주었습니다.
그러므로 w는 180 x 0.005 = 0.9 입니다.
.
위 문제의 답은 3 입니다.
.
.

[시작] (가)에서 수용액 A 100mL의 질량은 100dg 입니다.
그러므로 (나)에서 B 20mL에는 4dg 만큼 들어있겠습니다.
(다)에 의해 수용액 A 4dg 안에 1mmol 만큼의 아세트산이 있었음을 확인할 수 있습니다.
정리해보면 수용액 A 4dg 안에 아세트산 1mmol이 들어있습니다.
문제 맨 마지막에서는 A 100g에 들어있는 아세트산의 질량이 x g 이라고 해놓았습니다.
그러므로 25/d mmol 의 아세트산은 x g에 해당되겠습니다.
x / 60 = 1 / 40d 이므로 2xd = 3 입니다. (ㄷ 틀린보기)
.
A 수용액 4mL 안에 아세트산 1mmol 이 들어있는 것이므로 몰농도는 0.25가 되겠습니다.
.
위 문제의 답은 ㄱ 입니다.
.
.

[시작] V L에 해당되는 기체의 몰수를 1mol 이라고 편의상 놓아보겠습니다.
.
(가)와 (나)의 차이는 XYn이 ag 에서 2ag으로 늘었다는 것입니다.
그러므로 XYn ag은 1mol이 됩니다.
자연스럽게 X2Yn bg은 1mol이 됩니다.
.
(가)에 들어있는 Y 원자수는 2n 이고
(나)에 들어있는 X 원자수는 4 이므로
n = 4 가 되겠습니다.
.
위 문제의 답은 ㄱ 입니다.

[코멘트] 문제 초반에서 VL의 기체 몰수를 1mol로 놓은 부분을 기억하시나요?
화학에서는 이런 단계가 매우 중요합니다.
논리적으로 말만 된다면 간단하게 가는 연습을 해봅시다.
.
.

[시작] 금속과 금속 양이온의 반응 문제입니다.
이런 문제가 나오면 꼭 기억해야 하는 불변의 진리가 있습니다.
"반응전 총 전하량의 합은 반응 후에도 유지된다."
.
과정 (가)를 보면 반응전 총 전하량 합은 10입니다.

그러므로 m = 2 가 되어야 하겠습니다.
.
과정 (나)에서도 추가적인 양이온을 넣어주지 않았으므로 전하량 합은 10으로 유지됩니다.
이때 총 양이온 수가 4이므로 양이온 하나당 2.5의 전하량을 가지면 되겠습니다.
m = 2 이므로 n이 3이여야만 합니다.
3이 아닌 1, 2 중 하나라면 양이온 하나당 2.5의 전하량을 가질 수 없기 때문입니다.
그러므로 (나)에서는 B2+ 2개 / C3+ 2개가 존재하게 됩니다.
.
위 문제의 답은 ㄴ, ㄷ입니다.
.
.
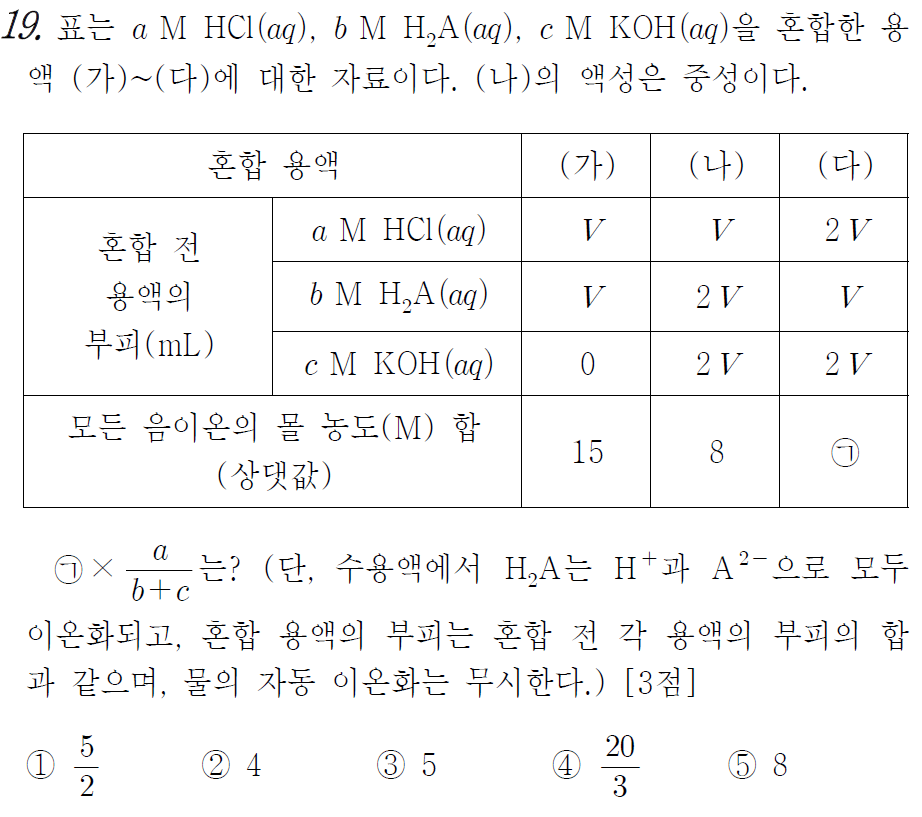
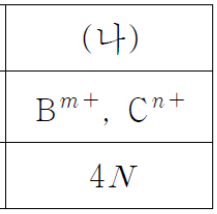
[시작] (가)와 (나)의 부피비는 2 : 5 입니다.
이때 (가)와 (나)의 모든 음이온 몰 농도 합의 비는 15 : 8 입니다.
그러므로 (가)와 (나)에 들어있는 음이온 몰수비는 3 : 4 가 되겠습니다.
저는 (가)에 음이온 몰수가 3, (나)에 음이온 몰수가 4라고 놓아보겠습니다.
.
용액에 들어있는 총 음이온수를 구할 때는 저만의 루틴이 있습니다.
일단 액성을 파악합니다.
만약 산성이라면 초기 산에 들어있던 총 음이온 수를 '기준값'으로 생각합니다.
그 후 염기를 넣어준다고 생각할 때, 기준값에서 변화가 있는지 고려해봅니다.
.
(가) 용액에서는 다행히도 산성 용액 밖에 없습니다.
그러므로 HCl과 H2A를 합하여 3개가 들어있겠습니다.
.
(나) 용액은 중성입니다.
중성일때는 초기 산에 들어있던 총 음이온 수를 기준값으로 생각하든,
초기 염기에 들어있던 총 음이온 수를 기준값으로 생각하든 상관이 없습니다.
초기 산에 들어있던 총 음이온 수는 4가 되어야 하겠습니다.
그러므로 HCl과 H2A를 합하여 4개가 들어있어야 합니다.
즉 H2A VL 에는 1개가 들어있으며 HCl VL 에는 2개가 들어있습니다.
자연스럽게 KOH 2VL 에는 6개가 들어있습니다.
.
위 문제의 답은 3번 입니다.
.
.
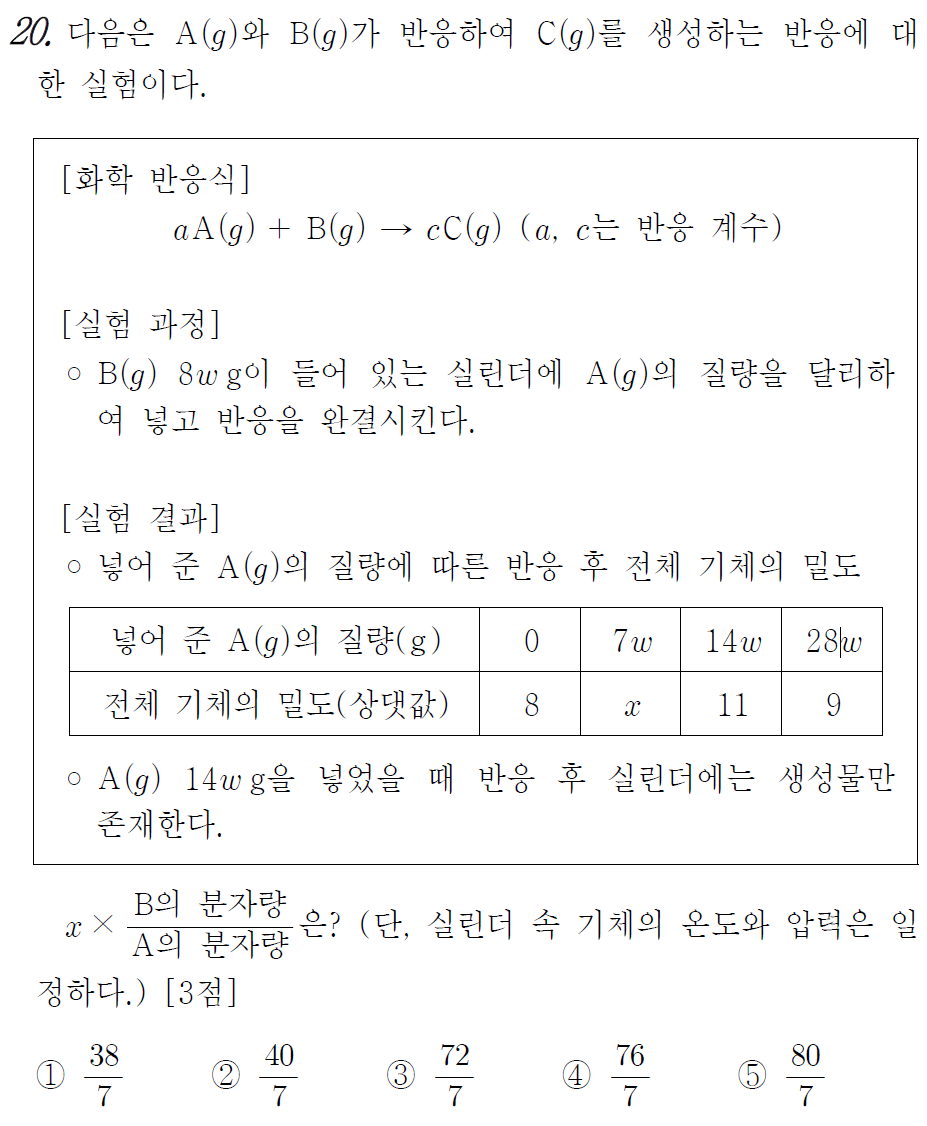
[시작] B 8wg만 있었을 때 밀도가 8이므로
저는 B 8wg의 부피를 1L 라고 놓아보겠습니다.
아니, 더 나아가 1mol 이라고 놓아보겠습니다.
.
A를 14wg 넣어주었을 때 전체 질량은 22w 이므로
밀도가 11이 되려면 C는 2mol 생성되어야 하겠습니다.
B 1mol 이 모두 반응하였을 때 C 2mol 이 생성되었으므로 c = 2 가 됩니다.
.
A를 28wg 넣어주었을 때 전체 질량은 36w 이므로
밀도가 9가 되려면 전체 기체의 몰수는 4mol 이여야 합니다.
이때 C는 여전히 2mol 존재하므로 A 14wg의 몰수가 2mol 임을 알 수 있습니다.
A 14wg을 넣어주었을 때 C가 2mol 생성되었으므로 a = 2 가 됩니다.
반응계수비는 2 : 1 : 2 입니다.
반응질량비는 14 : 8 : 22 = 7 : 4 : 11 입니다.
두 비율값을 나누면 분자량비가 나옵니다.
분자량비는 A : B : C =7 : 8 : 11 입니다.
.
위 문제의 답은 5번 입니다.

[코멘트] 문제 초반에서 그냥 B 8wg을 1mol로 놓은 부분을 기억하시나요?
화학에서는 이런 단계가 매우 중요합니다.
논리적으로 말만 된다면 간단하게 가는 연습을 해봅시다.
'화학1 해설 저장소 > 교육청, 평가원 모의고사 해설' 카테고리의 다른 글
| 화학1 - 2025학년도 수능 주요 문항 2편 : 킬러 문제들의 난이도? (0) | 2024.11.19 |
|---|---|
| 화학1 - 2025학년도 수능 주요 문항 1편 : 난이도 조절에 실패하다? (0) | 2024.11.19 |
| [고등화학1] 2024학년도 고2 9월 모의고사(전국연합학력평가) : 어떻게 시작하는지 잘보세요 (0) | 2024.09.06 |
| [고등화학1] 2025학년도 평가원 고3 9월 모의고사 : 2가지 특이사항이 있습니다 (0) | 2024.09.04 |
| [고등화학1] 2024년 고3 5월 모의고사(전국연합학력평가) : 쉬웠지만 중요한 것은 혼자만의 사색입니다 (0) | 2024.08.29 |



