화학1 2025 수능완성 1단원 "용액의 농도" 문제 풀이 입니다.
.
.
문제를 처음부터 끝까지 눈으로 푸는 것은 소수만 할 수있을 겁니다.
하지만, 눈으로 문제를 보고 "어떻게 시작해야 할지" 고민하는 연습은 누구나 할 수 있겠습니다.
"시작"을 옳은 방향으로 간다면,
그 이후에 이어지는 풀이는 자동으로 따라오기 때문에 한번 연습해보시면 좋을 것 같습니다.
문제 사진 아래에는 어떻게 시작하면 좋을 지,
[시작] 을 적어놓았습니다.
여러분의 생각과 한번 비교해보세요!
.
.
<2점 문제>

[시작] 문제에서 나온 비율은 두가지 입니다.
이를 이용하기 위해서는 어떤 한 변수의 비율을 임의로 잡고 시작해야 겠습니다.
저는 용질의 양이 두 지점에서 동일하다고 생각해보겠습니다.
그러면 용매의 양의 비율은 왼쪽 지점부터 7 : 2 입니다.
또한 퍼센트 농도가 2 : 5 이므로 용액의 질량비는 5 : 2 이여야 합니다. (용질의 양을 동일하다고 놓았으므로)
.
두지점에 들어있는 용질의 질량을 a로 놓고,
왼쪽 지점에 들어있는 용매의 질량을 7b, 오른쪽 지점에 들어있는 용매의 질량을 2b로 놓아봅시다.
용액의 질량비는 5 : 2 이므로 a + 7b : a + 2b = 5 : 2 입니다.
3a = 4b 입니다.
위 문제의 정답은 3번입니다.
.
.

[시작] 수용액 I, II, III의 몰농도가 모두 같다.
용질의 몰수비는 6:3:2 이므로, 부피도 6:3:2이다.
.
.

[시작] 용액 I, II 의 몰농도 비는 4:3이다.
용액의 부피비는 15:4 이다. 따라서, 용질의 몰수비는 5:1 이다.
.
.
<3점 문제>
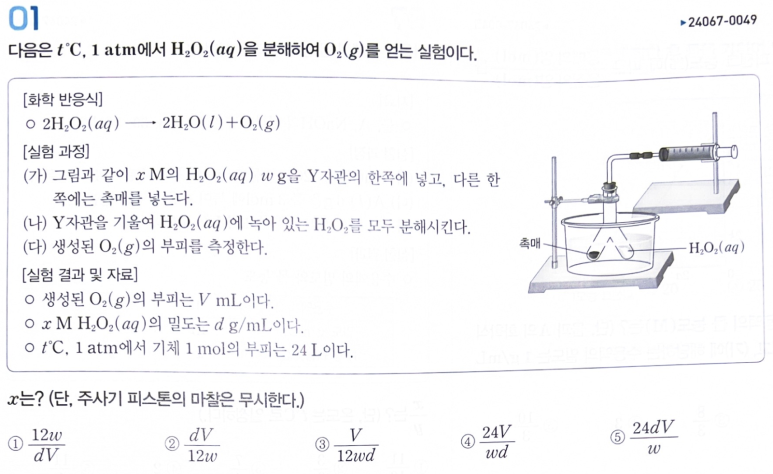
[시작] O2가 V/24 mmol 생겼기 때문에, 처음 있었던 H202의 몰수는 V/12 mmol 이다.
xM H202의 밀도가 dg/mL 이므로, wg이려면, 부피는 w/d mL 가 필요하다.
따라서, H202의 몰수는 (xw)/d mmol 이다.
(xw)/d mmol = V/12 mmol
.
.
수능완성 "용액의 농도" 파트에서 문자가 좀 많이 나오고 있습니다.
문자사이의 비율관계를 잘 이용하는 연습이 필요하겠습니다.
.
.
<2점 문제>의 5번은 2025학년도 고3 9월 모의고사에서 그대로 연계되었습니다.
아래 링크에서 문제를 확인해보세요.
[고등화학1] 2025학년도 평가원 고3 9월 모의고사 : 꼭 다시 풀어보아야 하는 주요 문제 풀이 해설
2024.09.04에 시행된 화학1 2025학년도 평가원 9월 모의평가에서 주요문제를 가져와보았습니다. .. 점수가 기대보다 못미치나요? 정말로 괜찮습니다. 이번 시험에서 어떤 점수를 맞았든, 여
juningscience.tistory.com
'화학1 해설 저장소 > 2025 수능완성 해설' 카테고리의 다른 글
| [고등화학1] "중화반응 3점 (2025 수능완성)" : 전체 이온수를 잘 구할 수 있어야 합니다 (0) | 2024.08.09 |
|---|---|
| 화학1 (2025 수능완성) - 중화반응 2점 : 풀이 시간을 단축하는 시작? (0) | 2024.08.09 |
| 화학1 (2025 수능완성) - 동위원소 문제 : 비율만 잘 구하면 됩니다 (0) | 2024.08.09 |
| [고등화학1] "화학반응식과 양적관계 (2025 수능완성)" : 효율적인 시작을 고민해야 합니다 (0) | 2024.08.09 |
| [고등화학1] "화학식량과 몰 (2025 수능완성)" : 어떻게 풀어야 할까? (0) | 2024.08.09 |



