2025 수능완성 "중화반응(2점)"에 이은 3점문제를 가져와보았습니다.
[2점 문제 바로가기]
.
.
화학1에서 "양적관계"보다는 "중화반응" 문제들이 더 수월하기 때문에,
자신감을 가지고, "어떻게 시작해야 할지"에 초점을 맞추어 문제를 살펴보면 좋을 것 같습니다.
.
.
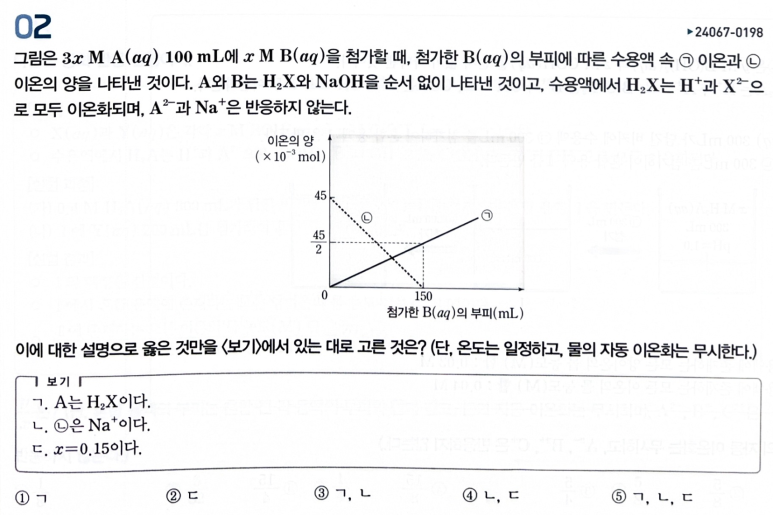
[시작] 우선, ㄴ은 없어지는 이온(H+ or OH-)이다.
"ㄱ 이온"이 "초기 ㄴ 이온수"의 절반만 들어가도 ㄴ은 다 없어진다.
따라서, ㄴ은 OH- 이여야 하고, ㄱ은 X2- 이다.
.
.

[시작] 용액 (가)가 가장 간단하기 때문에, 먼저 살펴보겠다.
용액에 들어있는 전체 이온전하량의 합은 0이 되어야 한다.
용액 (가)에 들어있는 이온 몰수비는 3:4:5 인데,
이중에서 B2+ 로 가능한 것은 "4" 뿐이며, 나머지 "3", "5"는 모두 음이온이여야 한다.
따라서, 용액(가)는 염기성이다.
.
.

[시작] 우선, x는 0.05 (실수 주의) 이며, 초기 H2A 용액에서 총 양이온의 수는 30mmol 이다.
용액 I 에서 총 양이온의 수는 18mmol 이다.
여기서 두가지 경우의 수가 생긴다.
I 이 산성이라고 가정해보자.
ㄱ은 B(OH)2 이며, 12mmol 들어왔을 것이다.
그리고 용액 I 의 총이온수는 33mmol 이다.
이때, 용액 II 의 총이온수는 36mmol 이므로 용액 II는 염기성이여야 한다.
36mmol (B(OH)2의 총 이온수) + x ( ㄴ염기의 총 이온수) - 15mmol ( H2A 의 분자수) = 36mmol (용액 II 의 총이온수) 이므로, ㄴ은 7.5mmol 들어오면 된다.
.
.
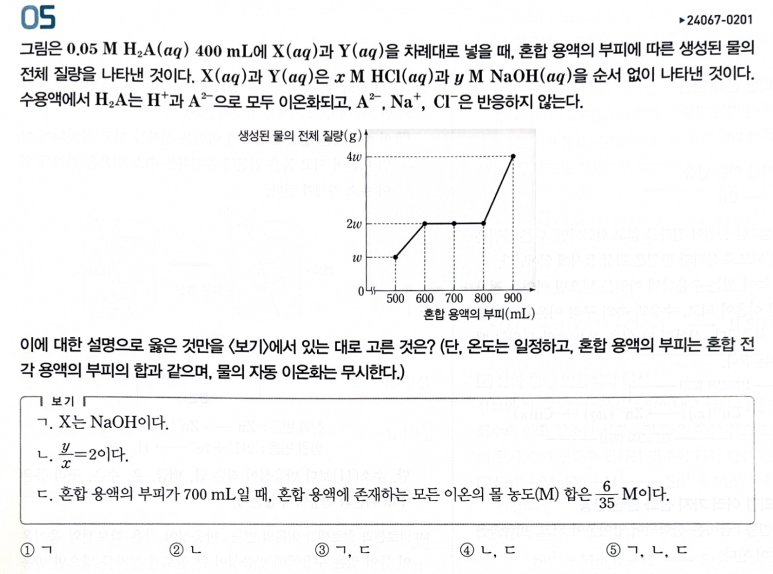
[시작] 처음부터 물이 생기기 시작했기 때문에, X는 NaOH 이다.
물이 2wg 생긴 시점에서 중화점이며, 이후에 추가적으로 물이 생기기 위해서는 NaOH가 중화점이후로도 200mL
더 추가되었다고 보아야 한다.
NaOH 200mL 에서는 물이 2w 생길 수 있는 OH- 가 들어있다.
그런데, HCl 100mL 를 넣어줬는 데, 바로 물이 2w 추가로 생겼기 때문에,
HCl 100 mL 에서 물이 2w 생길 수 있는 H+ 가 들어있을 것이다.
.
.

[시작] 용액 I 에 들어있는 양이온의 몰 수는 190mmol 이다.
초기 0.4M H2A 에 들어있는 양이온 수는 240mmol 이였다.
따라서, X는 2가 염기인 C(OH)2 이며, 50mmol 들어왔다.
.
.
이렇게 2025 수능완성 화학1 "중화반응" 문제를 살펴보았습니다.
제 느낌으로는 "양이온 수", "전체 이온수" 와 관련된 문제가 많았고,
이를 구하는 과정에 있어서, 버퍼링이 걸리지 않도록 보충해나가면 좋을 것 같습니다.
.
.
감사합니다.
'화학1 해설 저장소 > 2025 수능완성 해설' 카테고리의 다른 글
| [고등화학1] 실전모의고사 1회 (2025 수능완성) 2편 : pH - pOH 절댓값이 같다면 무슨 의미일까? (0) | 2024.08.28 |
|---|---|
| [고등화학1] 실전모의고사 1회 (2025 수능완성) : 시간 줄이는 풀이법은 무엇일까? (0) | 2024.08.27 |
| 화학1 (2025 수능완성) - 중화반응 2점 : 풀이 시간을 단축하는 시작? (0) | 2024.08.09 |
| 화학1 (2025 수능완성) - 동위원소 문제 : 비율만 잘 구하면 됩니다 (0) | 2024.08.09 |
| [고등화학1] "용액의 농도 (2025 수능완성)" : 비율 관계에 집중해야 합니다 (0) | 2024.08.09 |



