2025 수능완성 실전모의고사 1회 주요 문항 풀이 2편에 이은 3편입니다.
[2편 바로가기]
[고등화학1] 실전모의고사 1회 (2025 수능완성) 2편 : pH - pOH 절댓값이 같다면 무슨 의미일까?
[고등화학1] 2025 수능완성 실전모의고사 1회 : 시간 줄이는 풀이법, 시작방법 1편2025 수능완성 실전모의고사 1회에서 주요 문항을 가져와보았습니다. 그냥 풀이가 아닌, 시간을 줄이는 풀이법과
juningscience.tistory.com
.
.
그냥 풀이가 아닌, 시간을 줄이는 풀이법과 시작방법을 적어보았습니다.
문제 사진 아래에 [해설]은 저만의 해설을 적은 것이고,
[시작]은 이 문제를 푸는 데에 있어서 가장 효율적인 시작을 적은 것입니다.
문제 아래에는 [해설], [시작] 중 하나가 있겠습니다.
그럼 시작해보겠습니다.
.
.

[해설] 실험 결과에서 H2Y를 넣지 않았을 때, 몰농도(상댓값) 15에 대응되는 값은 2a입니다.
아.. 근데, H2Y 5mL 넣었을 때, 몰농도(상댓값) 9에 대응되는 이온이 누구인지는 아직 잘 모르겠네요.
일단 X+ 라고 해봅시다. 생각하기 더 쉬우니까요.
몰수는 같으므로, 몰농도비가 5:3이라는 것은 부피비가 3:5 = V:V+5 라는 것입니다.
따라서, V는 7.5 입니다. H2Y 10mL 넣었을 때도 생각해봅시다.
이때도, 몰수는 같으므로 H2Y 0mL 넣었을 때랑 비교하면, 몰농도비는 3:1이므로 부피비는 1:3입니다.
그런데 모순입니다. 따라서, 몰농도의 주어는 X+가 아닌 OH- 입니다.
5mL 넣었을 때, OH- 몰농도는 6a/5 = (2aV - 10a) / (V+5) 입니다.
양변을 a로 약분하면, 1.2(V+5) = 2V - 10 이므로 V = 20mL 입니다.
결국, (가)에서 만들어진 용액은 염기성이고, (가)의 15mL 속에는 X+ 20a mmol / OH- 10a mmol / Y2- 5a mmol 이 들어있습니다.
이제 다왔습니다. 맨 마지막 조건을 해석해봅시다.
맨 마지막 조건에서 음이온의 평균전하량 : 양이온의 평균전하량 = 8 : 7 이 되어야 합니다.
그런데, 양이온의 평균전하량은 무조건 1이므로, 음이온의 평균전하량은 8/7입니다.
따라서, 1가 음이온 몰수 : 2가 음이온 몰수 = 6 : 1 이여야 합니다.
이때, 음이온의 몰농도는 1/5 이므로, 총 몰수는 7mmol 입니다.
그러므로 1가 음이온 몰수는 6mmol, 2가 음이온 몰수는 1mmol 이 (다)에 들어있습니다.
2가 음이온 몰수 1mmol 은 아까 구한 Y2- 5a mmol 과 대응되므로, a = 0.2 입니다.
또한, (다)는 산성이므로 1가 음이온 몰수 6mmol 은 모두 Z- 입니다.
따라서, HZ의 몰농도 b는 6/20 = 0.3 입니다.
위 문제의 정답은 2번 입니다.
.
.
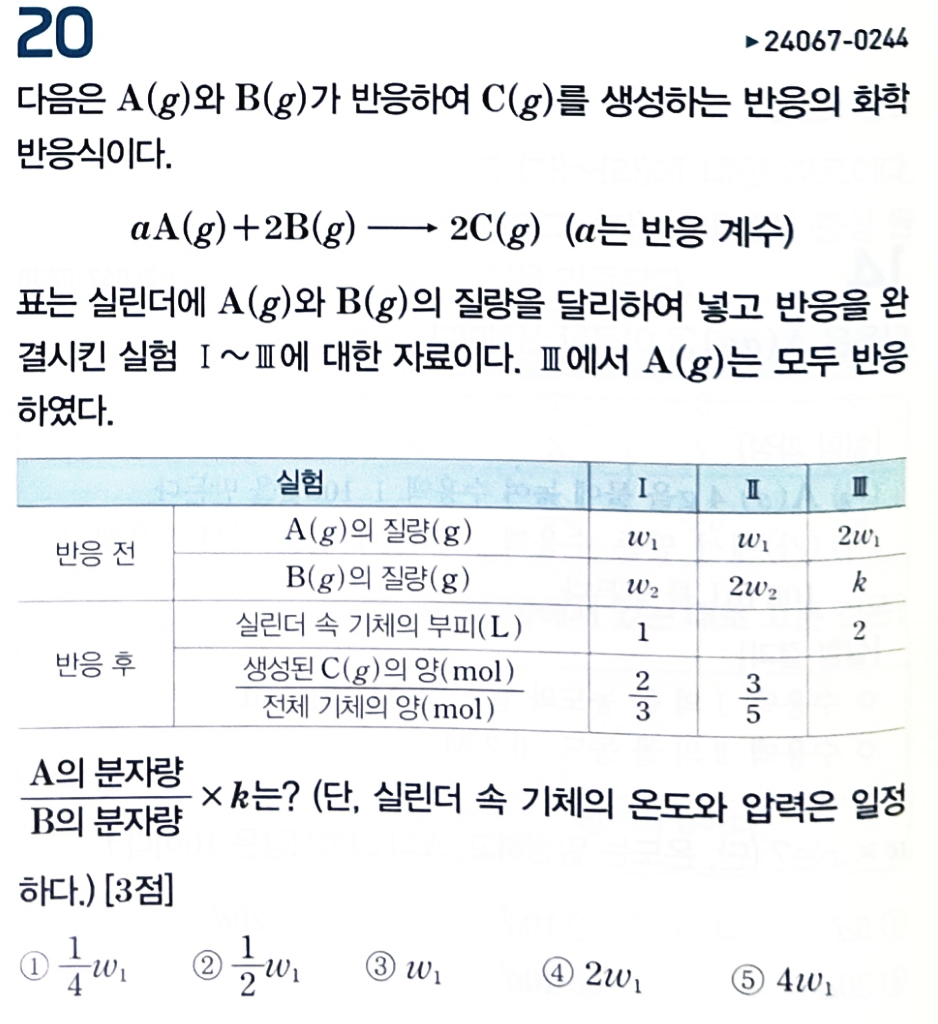
[해설] 만약 실험 I에서 A가 한계반응물이라면, 실험 II에서도 A가 한계반응물입니다.
A(g)가 한계반응물이면, 애초에 A를 빼고 화학반응식을 바라봐도 됩니다.
2B -> 2C
위 화학반응식의 특징으로 인해, 반응 후 기체의 양이 반응 전 초기 B의 양과 같습니다.
그러므로, 실험 I과 II의 전체 기체의 양은 1 : 2 이고, 생성된 C의 양은 같아야 하는데, 모순입니다.
따라서 실험I에서는 B가 한계반응물입니다.
실험I에서 C가 2mol 생겼다라고 하면, A가 1mol 남은 것이므로
B는 반응전 2mol 있었고, A는 반응전 a+1 mol 있었던 것입니다.
실험II에서 반응전 A는 a+1 mol, B는 4mol 이 존재합니다.
이때, 만약 B가 한계반응물이라면 A는 2a 만큼 반응해야 하고, a=1 이여야만 합니다.
근데, 이렇게 했을 때, C의 양 / 전체 기체의 양 비가 3/5 가 안되기 때문에 모순입니다.
그러므로, 실험II는 A가 한계반응물입니다. 반응 후 총 몰수는 초기 B의 몰수와 같으므로, 3/5 = 2.4/4 입니다.
즉, A가 a+1 mol 반응하면 C가 2.4 mol 생깁니다.
화학반응식에서 C가 2.4mol 이 생기기 위해서는 6a/5 mol의 A가 반응해야 합니다.
a+1 = 6a/5 이므로 a=5가 됩니다.
a를 구하기 까지가 약간 까다로웠던 것 같고, 그 이후로는 여러분들이 잘 따라갈 수 있을 겁니다.
위 문제의 정답은 3번입니다.
.
.
이렇게 2025 수능완성 실전모의고사 1회를 풀어보았습니다.
솔직히 1회를 시간안에 모든 푸셨다면 진짜 대단한 겁니다.
잘 안풀렸던 문제는 다시 한번 어떻게 해야 효율적으로 풀이할 수 있을 지 혼자 고민해보세요.
고민의 시간만이 실력 향상의 시간입니다. 화이팅!
'화학1 해설 저장소 > 2025 수능완성 해설' 카테고리의 다른 글
| [고등화학1] 실전모의고사 2회 (2025 수능완성) 2편 : 절대 진리를 알아봅시다 (0) | 2024.08.30 |
|---|---|
| [고등화학1] 실전모의고사 2회 (2025 수능완성) 1편 : 효율적인 시작방법을 알아봅시다 (0) | 2024.08.30 |
| [고등화학1] 실전모의고사 1회 (2025 수능완성) 2편 : pH - pOH 절댓값이 같다면 무슨 의미일까? (0) | 2024.08.28 |
| [고등화학1] 실전모의고사 1회 (2025 수능완성) : 시간 줄이는 풀이법은 무엇일까? (0) | 2024.08.27 |
| [고등화학1] "중화반응 3점 (2025 수능완성)" : 전체 이온수를 잘 구할 수 있어야 합니다 (0) | 2024.08.09 |



