화학1 EBS 만점마무리 봉투모의고사(2024) 2회에서 주요 문제를 가져와보았습니다.
2편입니다.
[1편 바로가기]
[고등화학1] EBS 만점마무리 봉투모의고사 2회(2024) 주요 문제 풀이 1편
화학1 EBS 만점마무리 봉투모의고사(2024) 2회에서 주요 문제를 가져와보았습니다. 1편입니다. 모든 문제의 저작권은 EBS에 있음을 밝힙니다. .. 그냥 풀이가 아닌, 시간을 줄이는 풀이법 또
juningscience.tistory.com
.
.
모든 문제의 저작권은 EBS에 있음을 밝힙니다.
.
.
그냥 풀이가 아닌, 시간을 줄이는 풀이법 또는 시작방법을 적어보았습니다.
문제 사진 아래에 [해설]은 저만의 해설을 적은 것이고,
[시작]은 이 문제를 푸는 데에 있어서 가장 효율적인 시작을 적은 것입니다.
문제 아래에는 [해설], [시작] 중 하나가 있겠습니다.
그럼 시작해보겠습니다.
.
.

[해설] 첫번째 꼭지에 의해 XZ2가 2개있고, Y2Z가 1개있다고 해봅시다.
두번째 꼭지에 의해 (가)에는 Y가 2개, Z가 5개 있으므로 Y 1개당 3.5w이고 Z 1개당 4w 이겠습니다.
(나)에서도 똑같이 Y가 2개, Z가 5개 있어야 하므로
XZ 1개, YZ2 2개가 들어있겠습니다.
(가)에서는 전체 원자수가 9개이고 (나)에서는 8개이므로
세번째 꼭지에서 1g에 들어있는 전체 분자수 비는 (가) : (나) = 5 : 5.5 입니다.
즉 평균 분자량 비는 (가) : (나) = 11 : 10 입니다.
이때 (가)와 (나)에 들어있는 총 분자수는 동일하므로 11 : 10을 전체 기체의 질량 비로 보아도 상관없겠습니다.
X의 원자량을 a라고 놓아봅시다.
(가)의 총 질량은 2a + 27w 이고 (나)의 총 질량은 a + 27w 입니다.
2a + 27w : a + 27w = 11 : 10 이므로 a = 3w가 되겠습니다.
즉 w1은 11w 이고 w2는 7w 입니다.
위 문제의 답은 4번입니다.
.
.

[시작] 실험 결과의 첫번째 꼭지에 주목해야 합니다.
II에서 양이온의 양과 음이온의 양은 같습니다.
불변의 진리를 생각해야 합니다.
"반응전 전하량의 합은 반응후에도 유지된다."
이온의 전하량 합은 "이온수 X 이온 하나당 전하량"인데
II에서는 양이온수와 음이온수가 동일하므로
양이온과 음이온 하나당 전하량도 동일해야 하겠습니다.
1로 동일해야 합니다. 따라서 ㉡은 HCl 입니다.
.
실험 결과의 두번째 꼭지에서 III은 산성이라고 했습니다.
산성이면 전체 양이온 수를 구할 때, 초기 산에 존재했던 양이온 수를 기준삼아 생각해주어야 편합니다.
거기에 NaOH를 넣어준다고 생각해보세요.
기준 잡았던 양이온 수에 변화가 있나요? 없습니다.
그러므로 III의 모든 양이온 수 9는 초기 산에 존재했던 양이온 수와 동일하겠습니다.
두 산의 농도가 y로 동일하므로 HCl 3개, H2X 3개로 놓아봅시다.
.
용액 II가 만약 산성이였다면 모든 양이온의 수가 3개이여야 합니다.
그렇지 않으므로 II는 염기성이며 NaOH는 초기에 4개 존재하여야 하겠습니다.
.
(가)의 액성은 산성입니다.
H2X는 3개이고 NaOH는 4개이기 때문이죠.
모든 이온의 몰수는 9개입니다. I의 총 부피는30mL입니다.
몰농도를 구해주면 0.3M 입니다. 하지만 문제에서는 0.6M으로 나와있습니다.
임의로 놓은 값에 모두 2배만 해주면 실제값으로 변환할 수 있겠습니다.
위 문제의 답은 3번 입니다.
.
.
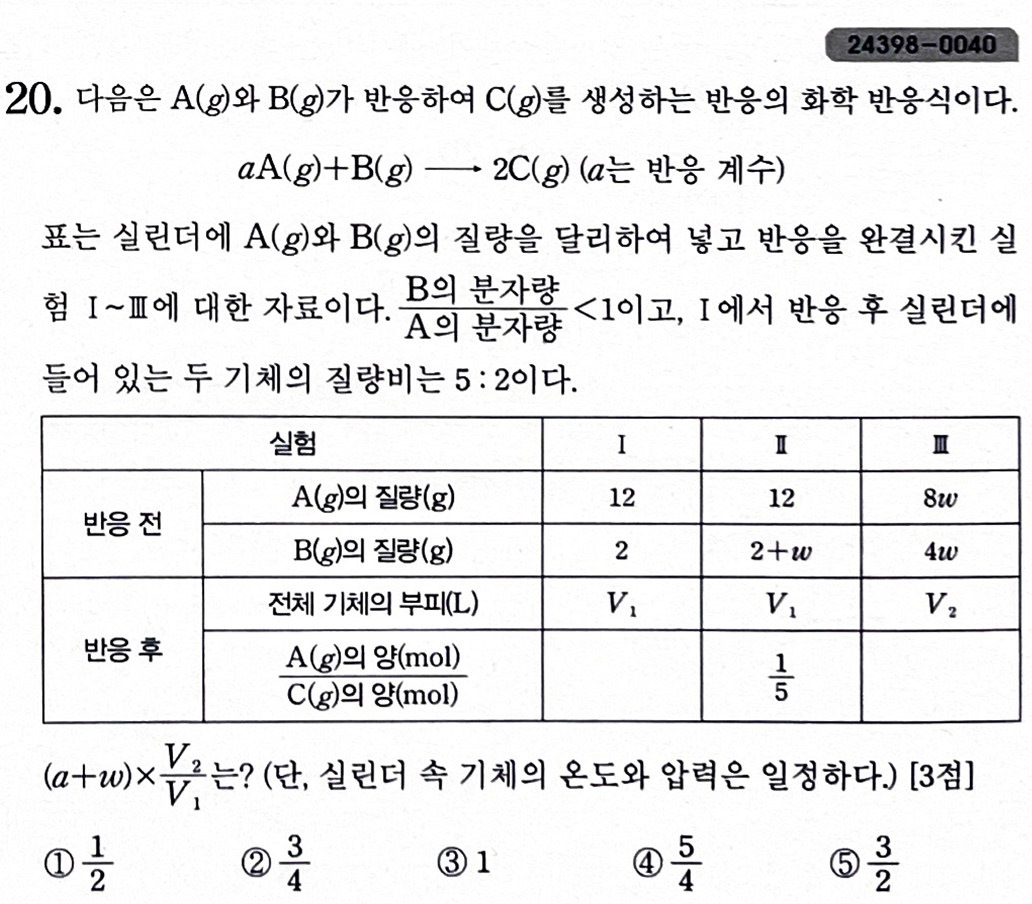
[해설] 실험II에서 I보다 많은 양의 B를 넣어주었는 데 A가 남았습니다.
그러므로 I에서도 B가 다 반응해야 하겠습니다.
이때 I에서 A가 a g만큼 반응했다고 해봅시다.
12 - a : a + 2 = 5 : 2 라고 해보면,
7a = 14 이므로 a = 2입니다.
따라서 반응 질량비는 2 : 2 : 4 = 1 : 1 : 2 가 되겠습니다.
.
실험 I과 II의 반응 후 부피가 동일한 것에 집중해봅시다.
I에서 B를 추가해준 반응이 실험 II 입니다.
반응 전에는 추가된 B만큼의 부피가 늘었을 겁니다.
근데 는만큼 다시 줄어야 부피 변화는 없을 것입니다.
반응 식에서 B의 반응계수가 1이므로 1만큼 B를 추가했다고 해봅시다.
다시 1만큼 전체 기체 수가 줄어야 하므로 a = 2 이여야 하겠습니다.
그런데 이러면 A 분자량 : B 분자량 = 1 : 2가 되어 모순입니다.
.
12 - a : a + 2 = 2 : 5 이여야 하고, a = 8 입니다.
그러므로 반응 질량비는 8 : 2 : 10 = 4 : 1 : 5 입니다.
반응 몰수비는 2 : 1 : 2 이므로 분자량비는 4 : 2 : 5 입니다.
위 문제의 답은 4번 입니다.
.
.
2회의 마지막 3문제는 다소 난이소가 좀 있습니다.
풀이과정을 꼭 한번 점검해보세요!
수고하셨습니다.
'화학1 해설 저장소 > 기타 자료 해설' 카테고리의 다른 글
| 화학1 - 고난도 중화반응 내신 기출 1편 : 가정하는 타이밍? (0) | 2024.11.26 |
|---|---|
| 화학1 - EBS 만점마무리 봉투모의고사 3회(2024) : 나만의 행동강령 만들어나가기 (0) | 2024.10.04 |
| 화학1 - EBS 만점마무리 봉투모의고사 2회(2024) 1편 : 특별한 스킬이 시간을 줄여주지 않습니다 (0) | 2024.09.24 |
| 화학1 - EBS 만점마무리 봉투모의고사 1회(2024) 2편 : 펜이 멈출때 가정하기 (0) | 2024.09.23 |
| 화학1 - EBS 만점마무리 봉투모의고사 1회(2024) 1편 : 금속의 반응성 문제를 주목하자 (0) | 2024.09.23 |



